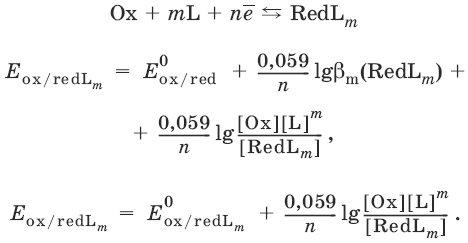
Чувствительность аналитической реакции. Предел обнаружения, или открываемый минимум, (m)P наименьшая масса вещества, открываемая данной реакцией по данной методике. Измеряется в микрограммах (1Pмкг = 10 6Pг).Предельная концентрация (clim)P наименьшая концентрация определяемого вещества, при которой оно может быть обнаружено в растворе данной реакцией по данной методике. Выражается в г/мл.Предельное разбавление (Vlim)P объем раствора с предельной концентрацией, в котором содержится 1Pг определяемого вещества. Предельное разбавление выражается в мл/г.Минимальный объем предельно разбавленного раствора (Vmin)P наименьший объем (мл) раствора определяемого вещества, необходимый для его обнаружения данной реакцией.mP= Clim Vmin 106,Вычисление рН водных растворовсильных кислот: рН = lga(H+) = lg (c(H+) / f(Н+))сильных оснований: рН = 14 + lga(OH?) =P14 + lg (c(OH?) f(OH?))слабых кислот: рН = ?(рKкислоты lgc) =P ?Kкислоты ?lgcслабых оснований: рН = 14 ?рKоснования + ?lgcсолей, образованных сильным основанием и слабой кислотой: рН = 7 + ?pKкислоты +P?lgcсолисолей, образованных слабым основанием и сильной кислотой: рН = 7 ?Kоснования lgcсолисолей, образованных слабым основанием и слабой кислотой: рН = 7 + ?pKкислоты +P?pKоснованиякислого буферного раствора:щелочного буферного раствора:Вычисление буферной емкости. Емкость буферного раствора определяется количеством сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферного раствора, чтобы изменить его значение рН на единицу.Гетерогенное равновесие: осадок насыщенный раствор малорастворимого соединения. Гетерогенное равновесие между осадком малорастворимого соединения и его ионами в насыщенном водном растворе может быть представлено следующим уравнением:KtmAnnv - mKtn+ + nAnm-[Ktn+] = mPs; [Anm-] = nP sКонстанта равновесия обратимой реакции осаждения-растворения называется произведением растворимости Ks(или ПР) и выражается следующим образом:Ks = a(Ktn+)mP a(Anm-)n = (f(Ktn+) x [Ktn+])mP (f(Anm-)[Anm-])n = (ms)m(ns)n Pf(Ktn+)m Pf(Ann-)n = nnmmsm+nP f(Ktn+)m f(Anm-)n, или Ks = nn mm Psm+nРастворимость это свойство вещества образовывать гомогенные системы с растворителем. Молярная растворимость малорастворимого вещества (s), моль/л, выражается следующим образом:Зная молярную растворимость соединения KtmAnn, легко вычислить его растворимость в г/лP? по формуле:?P= sP M(KtmAnn)Массу малорастворимого вещества в любом объеме можно рассчитать по формуле:m(KtmAnn) = s(KtmAnn) M(KtmAnn) x Vр-раУсловие образования и растворения осадка. Осадок не образуется или растворяется, если произведение концентраций ионов осадка в растворе меньше величины произведения растворимости.[Ktn+]m[Anm-]n < Ks(KtmAnn)Осадок образуется или выпадает, если произведение концентраций ионов осадка в растворе больше величины произведения растворимости.[Ktn+]m[Anm-]n > Ks(KtmAnn).Равновесия в окислительно-восстановительных системах. Для обратимой окислительно-восстановительной реакцииOх +PneP- RedРавновесный потенциал Eox/red со стандартным потенциалом редокс-пары Eox/red и активностью окисленной и восстановленной формы связан уравнением Нернста:где R универсальная газовая постоянная, равная 8,314 Дж/моль К, Т температура по шкале Кельвина, К,PT число Фарадея, равное 96485 Кл/моль, а(Ох)P активность окисленной формы, a(Red)P активность восстановленной формы.При подстановке в уравнение значений универсальной газовой постоянной, числа Фарадея, температуры Т = 298 К и замены натурального логарифма на десятичный получается уравнение для расчета значения равновесного электродного потенциала редокс-пары при 25`C:Если в окислительно-восстановительных реакциях принимают участие ионы водорода, то уравнение Нернста выглядит следующим образом:Если окисленная или восстановленная форма окислительно-восстановительной полуреакции является малорастворимым соединением, то в формулу для вычисления равновесного потенциала такой системы входит величина произведения растворимости этого соединения.Если в окислительно-восстановительной полуреакции окисленной формой является комплексное соединение OxLm, характеризующееся константой устойчивости ?(OxLm), то равновесный окислительно-восстановительный потенциал вычисляется по уравнению:Направление и глубина протекания окислительно-восстановительных реакций. Обратимая окислительно-восстановительная реакцияаОх1 + bRed1P- аОх2 + bRed2 протекает в прямом направлении, если ?Е0 = Е0Ox1/Red2P Е0Ox2/Red1 > 0, И В обратном направлении, если ?Е0 < 0.Глубина протекания реакции, т.Pе. степень превращения исходных веществ в продукты реакции, определяется константой равновесия.Для окислительно-восстановительной реакции константа равновесия с потенциала-ми участвующих в реакции редокс-пар связана уравнением: Кислотно-основная классификация катионовI группа: Li+, NH4+, Na+, K+групповой реагент отсутствует.Свойства соединений: хлориды, сульфаты и гидроксиды растворимы в воде.II группа: Ag+, Hg22+, Pb2+ групповой реагент HCl (с(HCl) = 2 моль/л).Свойства соединений: хлориды не растворимы в воде.III группа: Са2+, Ва2+, Sr2+, Pb2+ групповой реагент H2SO4 (c(H2SO4) = 2 моль/л).Свойства соединений: сульфаты не растворимы в воде.IV группа: Al3+, Cr3+, Zn2+, As(III), As(IV), Sn2+групповой реагент NaOH (c(NaOH) = 2 моль/л), избыток.Свойства соединений: гидроксиды растворимы в избытке NaOH.V группа: Bi3+, Fe2+, Fe3+, Mn2+групповой реагент NH3 (конц.).Свойства соединений: гидроксиды нерастворимы в избытке NaOH и NH3.VI группа: Cd2+, Co2+, Cu2+, Ni2+групповой реагент NH4OH (конц.).Свойства соединений: гидроксиды нерастворимы в избытке NaOH, но растворимы в избытке NH3. Ион: Li+1.PРеактив, условия: Na2HPO4, конц. NH3.Уравнение реакции:3LiCl + Na2HPO4 = Li3PO4v + 2NaClP+HClНаблюдения: белый осадок.2.PРеактив, условия: Na2CO3, рН ? 7Уравнение реакции: 2LiCl + Na2CO3 = Li2CO3v + 2NaClНаблюдения: белый осадок.Ион: NH4+1.PРеактив, условия: NaOH, газовая камера.Уравнение реакции:NH4Cl + NaOH = NaCl + Н2O + NH3^Наблюдения: запах аммиака, фенолфталеиновая бумага краснеет.2.PРеактив, условия: реактив Несслера (смесь K2[HgI4] и KOH)Уравнение реакции:NH3 + 2K2[HgI4] + ЗKOH = [OHg2NH2]Iv + 7KI + 2Н2OНаблюдения: красно-бурый осадок.Ион: Na+1.PРеактив, условия: K[Sb(OH)6], насыщенный раствор, холод, рН ? 7, мешают NH4+, Li+Уравнение реакции:NaCl + K[Sb(OH)6] = Na[Sb(OH)6]v + KClНаблюдения: белый осадок.2.PРеактив, условия: Zn(UO2)3(CH3COO)8, предметное стекло, CH3COOH, мешает Li+Уравнение реакции:NaCl + Zn(UO2)3(CH3COO)8 + CH3COOK + 9Н2O = NaZn(UO2)3(CH3COO)9P9Н2Ov + KClНаблюдения: желтые кристаллы октаэд-рической и тетраэдрической форм.Ион: К+1.PРеактив, условия: Na3[Co(NO2)6], слабо-кислая среда, мешают NH4+, Li+.Уравнение реакции:2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]vP+ 2NaClНаблюдения: желтый осадок.2.PРеактив, условия: NaHC4H4O6, рН ? 7, мешает NH4+.Уравнение реакции: 2KCl + NaHC4H4O6 = K2C4H4O6v + NaCl + HClНаблюдения: белый осадок. Ион: Ag+1.PРеактив, условия: HCl, NH3P Н2OУравнения реакций:AgNO3 + HCl = AgClv + HNO3AgClv + 2NH3P H2O = [Ag(NH3)2]Cl +P2H2O[Ag(NH3)2]Cl + 2HNO3 = AgClv + 2NH4NO3Наблюдения: белый осадок, растворимый в избытке аммиака и выпадающий вновь при добавлении азотной кислоты (использовать спец. слив!).2.PРеактив, условия: К2СrO4, рНP= 6,5 7,5.Уравнение реакции:2AgNO3 + K2CrO4 = Ag2CrO4v + 2KNO3 Наблюдения: кирпично-красный осадок.Ион: Hg2+1.PРеактив, условия: HCl, NH3P Н2OУравнения реакций:Hg2(NO3)2 + 2HCl = Hg2Cl2v + 2HNO3Hg2Cl2v + 2NH3P H2O = [HgNH2]Clv + Hgiv + NH4Cl + 2H2
III. Аналитическая химия / Сборник основных формул по химии для ВУЗов
Комментариев нет:
Отправить комментарий